Grafik titik didih, beku dan cair Kimia SMA YouTube

Grafik titik didih, beku dan cair Kimia SMA YouTube
Jika dijabarkan, maka rumus hubungan antara titik beku larutan dan kemolalan ini akan terlihat seperti berikut ini. ΔT f = K f x massaMr x 1.000P: Keterangan: massa = massa zat terlarut (gram). Pahami Proses Kenaikan Titik Didih, Rumus, dan Penerapannya Juni 13, 2023. Materi Kimia Gaya Antar Molekul, Jenis dan Penerapannya

Rumus titik beku larutan
Hal ini terjadi karena kenaikan titik didih air dari 100° C berubah menjadi titik didih campuran air dan kentang. Perubahan dari titik didih air menjadi titik didih campuran inilah yang disebut dengan kenaikan titik didih. Kenaikan titik didih memiliki rumus sebagai berikut : ΔTb : Tb Larutan-Tb Pelarut. Dengan keterangan :
Melihat Proses Kenaikan Titik Didih Kimia Kelas 12
Tb = 100°C + ΔTb. = 100°C + 0,0416°C = 100,0416°C. Jadi, Tidik didih larutan tersebut yaitu 100,0416°C. Itulah ulasan mengenai √ Titik Didih : Pengertian, Kenaikan, Faktor, Rumus & Contoh Soalnya Lengkap. Semoga apa yang telah diulas dapat bermanfaat bagi pembaca. Sekian dan terima kasih.

Unduh Contoh soal titik didih dan titik beku larutan (sifat koligatif larutan) Tonton daring
Kenaikan Titik Didih dan Penurunan Titik Beku Untuk memahami konsep kenaikan titik didih larutan kita akan contoh dalam kehidupan sehari-hari yakni apabila ke dalam air dilarutkan suatu zat tertentu, seperti yang kita ketahui akan terjadi penurunan tekanan uap larutan, sehingga pada suhu $\mbox{100}^{\circ}\mbox{C}$ larutan air belum mendidih.
Kenaikan Titik Didih Dan Penurunan Titik Beku Riset
Kita akan belajar tentang kedua sifat tersebut berikut rumus dan contoh soalnya. Kenaikan Titik Didih Larutan.. Jika larutan tersebut kita anggap idela, tentukan berapa titik didih dan titik beku larutan. Diketahui Kb H 2 O = 0,512 o C kg mol-1 dan K f H 2 O = 1,86 o C kg mol-1 Jawaban. Mr dari urea CO(NH 2) 2 = 60 gram (C = 12, N = 14, H.

PERCOBAAN III SIFAT KOLIGATIF LARUTAN PENURUNAN TITIK BEKU (Kimia Dasar I) Blog Najih
Artikel ini membahas tentang rumus dasar keseteraan/perbandingan dalam penetapan skala suatu termometer lengkap dengan contoh soal dan pembahasannya.. Karena titik-titik ini (titik beku dan titik didih) berubah terhadap tekanan, maka tekanan harus ditentukan (bisanya sebesar 1 atm).

Rumus Kenaikan Titik Didih Dan Penurunan Titik Beku Siti
Pengertian dan Rumus Penurunan Titik Beku Menurut Rananda Vinsiah dalam Fenomena Sifat Koligatif Larutan Kimia Kelas XII (2020, hlm. 19), titik beku merupakan kondisi ketika tekanan uap suatu cairan sama dengan tekanan padatannya. Pada kondisi seperti itu, cairan akan mulai membeku. Seandainya ada suatu zat terlarut yang dicampurkan ke pelarut murni, akan tercipta larutan baru.

Tentukan titik didih dan titik beku larutan 32 gra...
T b° = titik didih pelarut murni (air) T b = titik didih larutan. Kenaikan titik didih hanya tergantung pada jenis pelarut dan molaritas larutan, tidak tergantung pada jenis zat terlarut. Jika ditambahkan zat terlarut yang tidak mudah menguap, misalnya gula, maka dibutuhkan kenaikan titik didih yang cukup besar agar dapat mendidih.

Soal Kenaikan Titik Didih Dan Penurunan Titik Beku Reverasite
Rumus untuk menentukan penurunan titik didih ( ∆T f) adalah: Untuk larutan elektrolit menggunakan rumus: Keterangan: ∆T f = Penurunan titik beku.. Tentukan titik didih dan titik beku larutan glukosa (C6H12O6) 18 gram dalam 10 gram air. (Kf air = 1,86 °C/m) Jawab: ΔTf = m x Kf

Sulastri buku142 Tugas 131 Contoh Soal Tentukan titik didih dan titik beku 6,20 g larutan
Kenaikan Titik Didih dan Penurunan Titik Beku Larutan Elektrolit Menurut Arrhenius, suatu zat elektrolit yang dilarutkan dalam air akan terurai menjadi ion-ion penyusunnya sehingga jumlah partikel zat pada larutan elektrolit akan lebih banyak dibandingkan dengan larutan nonelektrolit yang konsentrasinya sama. Hal ini menyebabkan sifat koligatif pada larutan elektrolit lebih besar daripada.

Kenaikan Titik Didih Penurunan Titik Beku Sifat Koligatif Larutan Reverasite
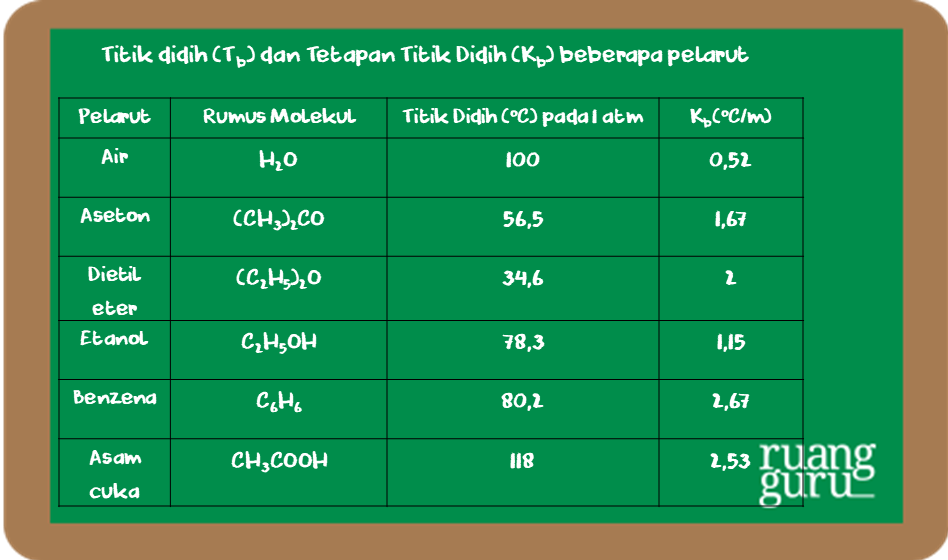
Untuk dapat membandingkan titik didih beberapa zat, di bawah ini diberikan data titik didih larutan dan tetapannya (K b). Untuk menentukan nilai kenaikan titik didih larutan dapat digunakan persamaan sebagaimana penentuan penurunan titik beku larutan. Persamaan yang digunakan adalah: ∆Tb = Tb (larutan) - Tb (pelarut) ∆Tb = m . Kb. Dengan.

10 Contoh Soal Sifat Koligatif Larutan Kenaikan Titik Didih Dan Penurunan Titik Beku Materi
Kenaikan titik didih adalah salah satu dari empat sifat koligatif larutan, yaitu sifat larutan yang dipengaruhi oleh partikel zat pelarut. Kenaikan titik didih larutan adalah peristiwa di mana titik didih suatu larutan akan lebih tinggi daripada pelarut murninya. Misalnya, air memiliki titik didih 100 derajat celcius.

Kenaikan Titik Didih Larutan Pengertian Dan Rumus Materiipa Com My XXX Hot Girl
tentukan titik didih dan titik beku larutan yang mengandung 18 gram glukosa , Mr 180 dalam 500 gram air. jika kb dan kf diketahui. sifat koligatif larutan..

Pengertian Titik Beku Pada Suhu Zat Cair LABORATORIUM SMK
Contoh soal dan pembahasan. Contoh soal 1. Sebanyak 2,4 gram urea (Mr = 60) dilarutkan dalam 50 gram air. Jika Kf air = 1,86 °C/m, tentukanlah titik beku larutan. Pembahasan. Pada soal ini urea sebagai zat terlarut dan air sebagai pelarut. Besaran yang diketahui sebagai berikut: gr = 2,4 gram. Mr = 60.

Rumus Penurunan Titik Beku Panduan Lengkap dan Detail
Rumus dan Perhitungan Penurunan Titik Beku. Perhatikan bahwa dalam kasus senyawa kovalen atau molekul non-elektrolit, nilai faktor van't Hoff (i) biasanya adalah 1, karena senyawa ini tidak mengionisasi dalam larutan.. Kenaikan titik didih: Pengertian, Sebab, Proses, Rumus, Faktor, dan Contohnya. Singular dan Plural: Pengertian, Perbedaan.

Membaca grafik titik didih dan titik beku larutan, pelarutsifat koligatif YouTube
Menurut Hukum Backman dan Raoult, penurunan titik beku dan kenaikan titik didih berbanding langsung dengan molalitas yang ikut terlarut di dalamnya. Berikut rumus persamaan untuk menentukan penurunan titik beku yang sebanding dengan hasil kali molalitas (m) dengan nilai penurunan titik beku molal (Kf). ΔTf = m x Kf. Keterangan: